10億分の1mの世界!生命科学者は「踊るタンパク質」の夢を見るか(下)
「見ること」による確信と革新(下)
好評シリーズ「WPI世界トップレベル研究拠点」潜入記第5回!
WPI(世界トップレベル研究拠点プログラム)は、異なる研究分野間、言語と文化の垣根を超えて世界の英知が結集する、世界に開かれた国際研究拠点を日本につくることを目指して2007年、文部科学省が策定した研究拠点形成事業で、2020年現在、全国に13研究拠点が発足しています。
13拠点のうち5拠点目となる「潜入記」の舞台は石川県。金沢大学ナノ生命科学研究所(WPI-NanoLSI)を訪ね、ナノサイズで躍動するタンパク質を見てきました!
【清水 修, ブルーバックス編集部】
けがの傷はなぜ治るのか?
さて、高速AFMの世界を堪能したところで、今度は松本教授から「スペシャルな顕微鏡をどんな研究に役立てているか」というお話をうかがうこととしよう。
 松本邦夫教授
松本邦夫教授
「では、まず、クイズです!」
え……たしか前回(I2CNERの時)も冒頭にクイズを出されたような。すでに毎回のお約束となったか。
「けがの傷が治るのは、なぜでしょう?」
んー。傷では、細胞が壊れてますよね。ということは、細胞が増えて、それを修復するから……ですかね。
「おー。残念ながら(笑)、半分正解です。まず細菌や死んでしまった細胞が取り除かれますが、同時に傷口の周りの細胞が『動く』、それに続いて細胞が増えます」
「これは、傷ついた細胞が修復されていくプロセスの動画です。上のほうはあまり変化がありません。それに対して下のほうは細胞が盛んに動いていますね」
「細胞が動くことは傷を治す時にとても大事なのです。ダイナミックに細胞が動いてスピーディーに傷を覆う。そういうことが実際に身体の中で起こっているわけですね」
こんなかんじに傷が治っていくのか! ところで、この上下の動画の違いはなんですか?
「『細胞増殖因子』というタンパク質が、あるかないかです。
具体的には、ぼくがずっと研究してきた『肝細胞増殖因子(HGF)』という、肝臓の再生に働くタンパク質が入っているかいないか。
HGFは、『肝細胞』増殖因子という名前ですが、皮膚や神経など、肝臓以外の細胞の傷なども治してくれます。上はHGFが入っていないもの、下はHGFが入っているものです。この画像は、2015年に『Nature Communications』に発表した論文(“Artificial human Metagonists based on macrocycle scaffolds” )のデータの一部です」
細胞を増やし、修復するHGFのすごい力
「HGFはまず『受容体』に結合します」
ハイドロイドアマナ制作のイメージCG “EGF mutation and cancer” by Amy Liu より
この藻みたいなのが受容体ですか?
「そう。細胞は『受容体』を使って細胞増殖因子をキャッチします。
受容体は、細胞の中から外までズボッと貫通しているのが特徴です。細胞増殖因子が受容体に結合すると、受容体のスイッチがONになって『細胞よ、増殖せよ!』とか、『細胞よ、動け!』といったシグナルが出る。その結果、細胞が増えたり動いたりするのです。
受容体は、いわば鍵穴ですね。物質を鍵、受容体を鍵穴として、細胞同士、あるいは外界と、物質のキャッチボールをするということ。『カギとカギ穴による物質コミュニケーション』が私たちの身体の活動の原理なのですね」
受容体って大事なんですねー。
「身体の細胞が増える仕組みにおいても、この受容体は大事です。
私たちの皮膚の細胞は日夜増えていくのですが、これは細胞が勝手に増えていくのではありません。正常な細胞の受容体が細胞の外から細胞増殖因子を受け取ると、増えるのです。
細胞増殖因子は代表的なものだけでも十種類程度あります。HGFのほかには、たとえば骨形成因子(以下、BMP:Bone Morphogenic Protein)など。BMPは骨を作る因子で、普段から身体の中に微量あるのですが、骨折したりすると、多く作られます。昔は、骨折すると添木して、あとは自然治癒力に任せてましたよね。意識せずとも増殖因子が働いて、骨が再生されるわけです」
なるほど、細胞増殖因子の働きによって細胞が増えたり、時には細胞がダイナミックに動いたりすることが自然治癒力なのだ。細胞膜を貫通している受容体が細胞の外で細胞増殖因子をキャッチして、細胞の中で生化学的な反応を起こす。そして細胞が2つに分裂したり、時には傷を塞ぐように動いたりする。
細胞増殖因子の種類によって『皮膚を作る』、『骨を作る』、『血管を作る』など役割の違いはあるが、すべて、この細胞増殖の根本的な仕組みによって身体の細胞が作られているのだそうだ。
 松本邦夫教授の説明は熱をおびる
松本邦夫教授の説明は熱をおびる
「ぼくがずっとやってきたのは、HGFという肝臓の再生に働くタンパク質の研究です。
肝臓は再生能力の高い臓器として古くから知られていました。たとえば、我々人間の肝臓は1.2kgくらいあるのですが、生体肝移植では、約400gくらいを切り取って他の人に移植します。すると、移植された肝臓は1ヵ月ほどで1kgにまで再生するのです」
「この肝臓の再生を担っているのがHGFです。HGFは700個近いアミノ酸がつながったタンパク質で、傷を治す活性がものすごく強い。さきほど見ていただいた動画でもわかりますよね」
あ、こちらの動画ですね。
たしかに、こちらのHGFありの動画では、細胞が躍動的に動いて表面を覆っていく。まるで波が浜辺に寄せるようだ……。
なるほど、HGFにはハンパない力を感じる。
HGFとがん細胞の問題を解決するHiP-8
「しかし、HGFには良い面ばかりでなく好ましくない面もあるのです。
今までお話ししたようにHGFは細胞の増殖を促すだけでなく、細胞の遊走や生存を促します。つまり傷を修復したり、細胞を生き延びさせたりする力が強いわけですが、これが仮に『がん組織』で作用した場合、がん細胞が広がったり、抗がん剤の作用をかいくぐって生き延びたりするのです」
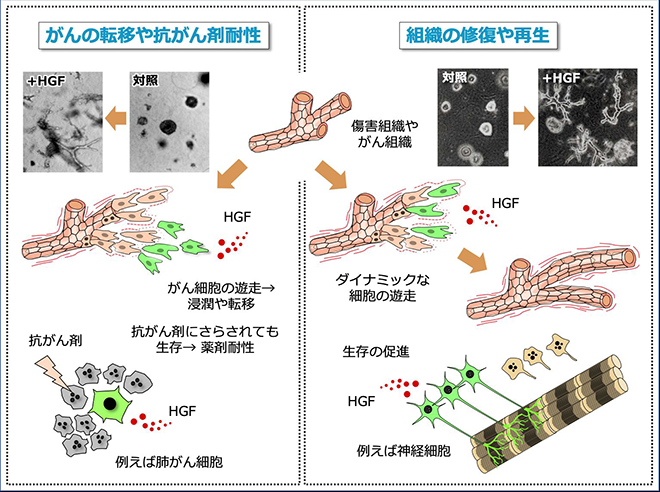 組織が再生する仕組みとがんの転移・薬剤耐性
組織が再生する仕組みとがんの転移・薬剤耐性
え! がん細胞が生き延びる⁉︎
「そうなんです。先ほどお話ししたように、傷を受けた組織がダイナミックに再生できるのは細胞増殖因子の強力な生理活性のおかげですが、一方でがん細胞はその強力な生理活性を巧みに使うのです。
これをご覧ください。培養中のヒトがん細胞にHGFを与えたもの(下)と与えないもの(上)を比較した動画です。HGFがなければそのままなのに、HGFがあるとがん細胞は周囲に広がっていきます」
あ、がん細胞が広がっていく。
「ですから、HGFの作用を止めることも必要になってくるわけです。
最近、HGFを阻害する物質を見つけたのですが、これは論文になって、2019年に『Nature Chemical Biology』に掲載されました(“Macrocyclic peptide-based inhibition and imaging of hepatocyte growth factor”) 。
ケミカルバイオテクノロジーがご専門の菅裕明先生(東京大学大学院理学系研究科教授)との共同研究です」
松本教授と菅教授は今回、「HGFにはまる環状ペプチドを探し出す」という成果を生み出した。環状ペプチドとは12個のアミノ酸が環状に繋がった小さな分子。HGFの「くぼみ」にぴったりくっつく環状ペプチド『HiP-8』を発見したのだ。
 HGFに結合してHGFを阻害する環状ペプチド(HiP-8)
HGFに結合してHGFを阻害する環状ペプチド(HiP-8)
「HiP-8はHGFのくぼみにピタッとくっつきます。すると、鍵であるHGFが鍵穴である受容体に結合できなくなってしまうのです。
受容体に結合できないので、当然、HGFは生理活性を発揮できません。つまりHGFの働きを阻害できることになる。それでは、HiP-8により阻害されたHGFはどのような状態になっているのか ? これを明らかにしたのが柴田准教授との共同研究です。
『普通のHGF』と『HiP-8がくっついたHGF』の動きを高速AFMで見た動画があります。まず、普通のHGFが受容体に結合しようとしている動画を見てみてください」
あれ? ほとんど動きませんね。踊ってない。
「そう、動かないので、受容体と結合できないのです。
この画像を見た時に『あ、阻害できた!』と確信しました。この世に医薬品は何百種類もありますが、こんなふうに標的のタンパク質の動きを止める研究を知りません。この止まった状態は我が研究所の高速AFMで見て初めて分かったことですね」
なるほど。スペシャルな顕微鏡によって、「HiP-8がHGFの動きを止めている状態」を確認できたんですね。 今後はこのHiP-8を実用化していくわけですか。
「実用化したいと思っています。そのための基礎研究と準備を積み重ねます」
高速AFMから始まる新たな研究
「やっぱり、ぼくたちは安易に信じてしまっていることがたくさんあるのです。
通常はタンパク質や細胞の動きのビフォーアフターだけを画像で見るものなので、その途中の動きのプロセスなんて研究者でも知りません。ところが、高速AFMを使って、実際にプロセスを動画で見てみると、今まで想定していた動きとは全然違う動きをしていたりする。
今日、お見せしたタンパク質の動きなども、もし、動画を見ていなかったら、ぼくも『まさか、そんな動きはしないだろう』と思ってしまうでしょうね」
まさに、見ることによる確信。「見る」という行為の凄みを感じる。

「これからも高速AFMを使って、どんどん見ていこうと思います。見ることから新たな研究が始まるのです」
少年の科学の心をそそる顕微鏡。それは研究の最前線を拓くツールでもあった。
いつの日か、金沢発のスペシャルな顕微鏡は、輝かしいパラダイム転換を実現してくれるに違いない。
(2019年12月2日。金沢大学松本研究室にて)

