100兆個以上!「おなかの中の花畑」は、我らを支えるパートナー(下)
2019年09月18日掲載
「腸内フローラ」は巨大パワーの小宇宙(下)
好評シリーズ「WPI世界トップレベル研究拠点」潜入記第3回!
WPI(世界トップレベル研究拠点プログラム)は、異なる研究分野間、言語と文化の垣根を超えて世界の英知が結集する、世界に開かれた国際研究拠点を日本につくることを目指して2007年、文部科学省が策定した研究拠点形成事業で、2019年現在、全国に13研究拠点が発足しています。
今回の舞台は大阪大学免疫学フロンティア研究センター(以下、IFReC)。拠点長の竹田潔教授に、みんなが気になる「おなか」の話を聞きました!
【清水 修, ブルーバックス編集部】
炎症性腸疾患の病理の解明を目指す
さて、腸内細菌に関する基礎的にして面白い話は十分堪能させていただいた。そろそろ、我々の素朴な疑問を竹田教授に尋ねてみよう……。
竹田先生、今日は2つ、うかがいたいことがあって来たのです。
ひとつは「なぜ、人間にとって異物である腸内細菌が免疫で攻撃されないのか?」ということ、もうひとつは「腸は人間と腸内細菌が仲良く共生しているところなのに、なぜ、炎症性腸疾患のような現象が起こってしまうのか?」ということ。
「実は、その2つの質問は、腸の内部にある『上皮細胞』というものが大きく関係してくるのです。上皮細胞というのは消化管の内側の表面にある組織で、食べ物を消化する酵素を分泌する機能と消化して作った栄養素を吸収する機能を備えています。
そもそも……免疫細胞の根本的な原理は、侵入してきた『異物』を認識して反応を起こして排除するというものです。
腸内細菌は『異物』ですから、免疫細胞は認識すれば反応します。たとえ病原菌でなくてもです。それなのに、健康な状態の腸では免疫細胞が腸内細菌を攻撃することはありません。これは免疫細胞がいるところと腸内環境の間を上皮細胞が仕切って免疫と異物をきれいに分けるバリアになっているからであろうと思われます。
ところが、炎症性腸疾患という病気はおとなしくしていた免疫細胞が暴走を始めて自らの身体を攻撃してしまいます。『暴走のきっかけは、上皮細胞のバリアが破られて免疫と異物(腸内細菌)が接触してしまうことなのではないか』。これが炎症性腸疾患の原因として考えられる第一の仮説です。
もうひとつの仮説は『腸内細菌を攻撃する免疫細胞はリンパ組織や免疫組織にいる細胞で、消化管にいる免疫細胞は腸内細菌に遭遇しても攻撃しないのではないか』という仮説です。
そのような仮説を立てて、私は炎症性腸疾患をひとつの標的として研究を続けてきました。今日は研究によって得られた成果をご紹介したいと思っています」
竹田教授の研究成果をうかがう前に、まずは「炎症性腸疾患」という病気について説明しておこう。
炎症性腸疾患は人間の免疫システムが異常をきたして、自分の免疫細胞が自分の腸の細胞を攻撃し、炎症を起こしてしまう病気である。この病にかかった患者は慢性的な下痢、血便、腹痛などの症状で苦しむ。
「そもそも、病気というものは、宿主(人間)側の分子や細胞が異常になって起こるケースと、感染症などの外部要因によって身体の恒常性が破綻するケースという、2つの要因があります。
私たちが研究対象としている炎症性腸疾患である潰瘍性大腸炎の原因は、先ほどお話しした仮説、『上皮細胞のバリア』に破れがあるのではないかと思っています。
ただ、上皮細胞のバリアに異常がありすぎると、上皮細胞は死んでしまうので、死ぬほどではない微妙な異常がある箇所があって、その中でもっとも腸内細菌が多い箇所で病気が発生し、広がっていくのではないかと考えています」
【 潰瘍性大腸炎の最新研究 】
消化管の上皮細胞はすべて粘液でおおわれている。
特に、膨大な数の腸内細菌がいる大腸はきわめて分厚い粘液層におおわれている。この分厚い粘液層は「内粘液層」と「外粘液層」という2つの層に分かれており、マウスなどで腸内細菌の侵入の度合いを調べてみると、外粘液層までは腸内細菌が侵入してきているが、内粘液層には腸内細菌が入ってきていないことが分かったという。
 腸管の管腔は、さまざまな腸内細菌で満たされる菌のパラダイスだ。しかし、彼らが腸内のバリアを破って粘膜固有層に侵入しようとしても、腸管上皮細胞に阻まれほぼ不可能だ
腸管の管腔は、さまざまな腸内細菌で満たされる菌のパラダイスだ。しかし、彼らが腸内のバリアを破って粘膜固有層に侵入しようとしても、腸管上皮細胞に阻まれほぼ不可能だ
つまり、「内粘液層の存在によって、腸内細菌と宿主は完全に隔離されている」と言えるのである。
「今まではこの上皮のゼリー状の粘液があると物理的に腸内細菌が阻まれるのではないかと考えられてきました。しかし、私は『他にも根本的なメカニズムが潜んでいるのではないか』と考えました。
そこで、これはうちの研究室の奥村君(竹田研究室助教)の仕事になるんですが、彼は『大腸上皮に発現している分子が何かを担っているかもしれない』と考えて、大腸上皮に特異的に発現している遺伝子を探しました。
そして、『Lypd8』という遺伝子を見つけてくれたのです。Lypd8は胃、小腸、盲腸、大腸にのみ発現している遺伝子で、特に盲腸と大腸には強く発現していました」
ここから、「Lypd8とは何者なのか」という竹田研究室の探索が始まる。そして、潰瘍性大腸炎患者の腸の観察とマウスによる実験等によって、以下のようなことが次々に分かってきた。
- 【1】健康な人の大腸上皮にはLypd8が発現しているが、潰瘍性大腸炎患者の大腸上皮にはLypd8がほとんど発現していない。
- 【2】健康なマウスでは大腸粘液層に腸内細菌が侵入していないが、Lypd8を欠損させたマウスでは大腸粘液層に多数の腸内細菌が侵入していた。
- 【3】健康なマウスと比較してLypd8欠損マウスの大腸には「プロテウス菌」、「大腸菌」、「ヘリコバクター菌」の3つが多く存在していた。この3つの菌はよく移動する「運動性の高い菌」である。
- 【4】化学物質により、健康なマウスとLypd8欠損マウスに腸炎を発症させたところ、Lypd8欠損マウスは腸炎が重症化して死亡することが多かった。
- 【5】大腸粘膜層に侵入してきたプロテウス菌にLypd8分子(タンパク質)が反応した後に電子顕微鏡で観察したら、Lypd8はプロテウス菌の鞭毛(これによって運動する)と結合していた。
- 【6】Lypd8分子とプロテウス菌を入れた寒天培地とプロテウス菌のみを入れた寒天培地を比較したところ、Lypd8を加えた寒天培地ではプロテウス菌の運動が抑えられていた。
つまり、これらのさまざまな観察・実験から、大腸上皮に存在するLypd8分子は腸内細菌の鞭毛にくっついて運動性を弱め、免疫細胞がいるところへ腸内細菌が侵入するのを防いでいることが分かった。
さらには、このような特性によって腸の恒常性をサポートする役割を果たしていることが分かったのである。
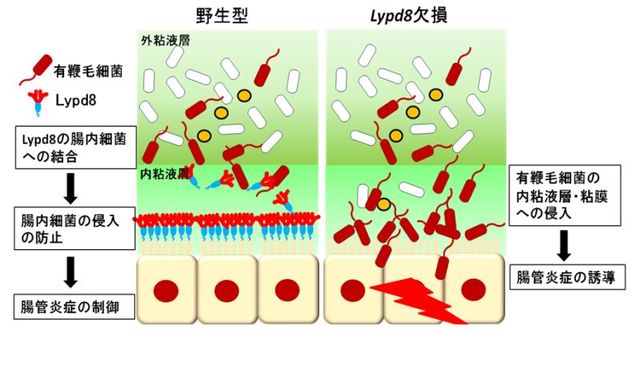 左:通常のマウス(野生型)においては、Lypd8が大腸上皮細胞に発現し、一部は大腸管腔に分泌される。分泌されたLypd8は腸内細菌に結合し、腸内細菌の粘膜への侵入を防止することで、腸管炎症を抑える。
左:通常のマウス(野生型)においては、Lypd8が大腸上皮細胞に発現し、一部は大腸管腔に分泌される。分泌されたLypd8は腸内細菌に結合し、腸内細菌の粘膜への侵入を防止することで、腸管炎症を抑える。
右:遺伝子を操作されLypd8 が作れないマウスでは、腸内細菌が粘膜層に侵入し炎症疾患を起こす。
「今後、このLypd8分子(タンパク質)を人間の大腸に補充して上皮粘膜層のバリアを強化することが可能になれば、潰瘍性大腸炎の新しい治療法になってくれるかもしれません。
今のLypd8の話からも、腸内細菌は基本的に宿主と接触しないシステムになっていて、常に消化管腔(消化管の中のスペース)という『外』に存在することが分かりますよね。
免疫系を活性化させるなど、いろいろと良い作用を行ってくれるのですが、それはすべて、宿主に直接作用するのではなく、代謝物、栄養素を産生することによって作用するわけです。単に栄養素という観点だけではなく、いろいろな生理活性がある代謝物があるのではないかなと思って、私も探してみたところ、乳酸とピルビン酸という代謝物が宿主の免疫細胞に作用していることを発見しました」
これは竹田研による「腸内細菌がつくる乳酸・ピルビン酸により免疫が活性化される仕組みを解明」という別の研究成果の話だ。
乳酸とピルビン酸は腸内で乳酸菌等が産生する代謝物なのだが、これらが小腸のマクロファージのGPR31という受容体に結合して、マクロファージの樹状突起の伸長を促すことを発見したのだ。
 左:乳酸菌などが産生する乳酸・ピルビン酸がマクロファージ上のGPR31に結合すると、マクロファージは樹状突起を伸ばし、病原性細菌を効率よく取り込む。その結果、病原性細菌に対する抵抗性が増加する。
左:乳酸菌などが産生する乳酸・ピルビン酸がマクロファージ上のGPR31に結合すると、マクロファージは樹状突起を伸ばし、病原性細菌を効率よく取り込む。その結果、病原性細菌に対する抵抗性が増加する。
右:乳酸・ピルビン酸が不十分なマウスでは、マクロファージの突起が伸びず、病原性細菌が取り込めない。
つまり、乳酸とピルビン酸がマクロファージを活性化させて、宿主の病原菌への抵抗性を高めるという仕組みを詳しく解明したことになる。
 乳酸・ピルビン酸によるマクロファージの樹状突起伸長
乳酸・ピルビン酸によるマクロファージの樹状突起伸長
マウスに乳酸・ピルビン酸を3週間与えた後、小腸マクロファージ(緑)の形態を顕微鏡で観察した。下図は上図の枠内を拡大。矢印は樹状突起を示す。野生型マウスのマクロファージでは乳酸・ピルビン酸の投与により発達した樹状突起が数多く観察される。GPR31遺伝子欠損マウスでは、樹状突起がほとんど観察されない。
Lypd8の話も乳酸とピルビン酸の話も、やがては創薬の段階に進み、効果的な治療薬や身体を活性化させる薬ができるのではないか。素人としては、つい、そんなふうに発展させることを考えてしまう。
「しかし、創薬までの道のりはまだまだ長いだろうなと思いますよ。乳酸とビルビン酸も、まだ創薬に関する話が出てきているわけではありませんし」
あ、もうひとつ、素朴な質問をしてよろしいですか……。今日、お話ししてくださったような「腸内細菌と免疫に関わる研究」は腸内細菌ゲノムが解明されてからいろいろと分かってきたことなのですか?
「そうですね。DNA解析によって腸内細菌が分かってから、この10年間くらいに世界中で一気に進みました。それでもまだまだ分からないことばかりです。なんせ、腸内細菌は1000種類もありますから、研究を進めるには、腸内細菌と代謝物とその作用を膨大な順列組み合わせで考えて、ひとつずつ実験によってつぶしていかなければなりません。なかなか気の遠くなる話です(笑)。
しかし、私が研究者として現役の間に、潰瘍性大腸炎の苦しみから患者さんを解放してあげたいといつも思っています」
そうですよね。臨床に生かしてこその医学研究ですね。
【 かれらはどこから来たのか? 】
「あ、最後にひとつ、おもしろいお話を……。実は、我々の消化管にいる腸内細菌ってどこからやってきたのか、まだ分かっていないんですよ」
え……? それはどういうことですか?
「腸内細菌は腸内で自然発生するわけではないので、どこからか入ってきたものです。しかし、そのほとんどは嫌気性菌なので、空気に触れると死にます。つまり、空気のないところからそのまま腸に入って来なければならないですよね。
いつのタイミングで入ってきたのか……。
出産の時にお母さんから乳酸菌を受け継ぐという話をしましたが、ラクトバチルスというその乳酸菌は空気があっても生きている菌なので、それを飲み込むというのは理解できるのです。しかし、赤ちゃんの成長とともに消化管で増えていく菌はどこからやってきたのか、まだ、よく分かっていないのです。最初はゼロですから。
まあ、本当は最初からおなかにいたかもしれないですけどね(笑)」
なんと、不思議な話だろう。おなかの中に兆単位の数で住んでいるのに、その祖先はどこからやってきたのか分からないとは……。
「そういうこともやがては解明されていくかもしれませんね」
うーん、奥が深い。話を聞けば聞くほど、内なる外である「腸内フローラの棲み家」はひとつの世界、いや小宇宙であった。
分からないことだらけのこの小宇宙の解明を目指して、これからも免疫研究者の探索は続いていくことだろう。
(2019年7月22日。大阪大学竹田研究室にて)
関連情報
過去記事
-

-

2020年11月5日
-

2019年9月17日

